

2015年10月1日修訂后的《中華人民共和國食品安全法》正式實施,保健食品備案制度也就此正式建立。2016年12月27日《保健食品原料目錄(一)》發布為保健食品備案正式拉開了序幕。該目錄2019年修訂,并于2020年11月23日正式發布為《保健食品原料目錄 營養素補充劑(2020年版)》,同時發布《允許保健食品聲稱的保健功能目錄 營養素補充劑(2020年版)》,2021年3月1日正式實施。首批進入備案的原料都是維生素和礦物質早已不能滿足國內保健食品市場發展需求,逐步放開功能原料進入備案目錄是眾望所歸。
① 2017年11月原保健食品審評中心第一次發布保健食品原料目錄研究招標;
② 2019年4月的市場監管總局發布輔酶Q10等5種保健食品原料目錄征求意見;
③ 2020年8月12日發布輔酶Q10等五種保健食品原料目錄備案產品技術要求的征求意見;
④ 2020年12月1日正式發布輔酶Q10等五種保健食品原料目錄的公告,包括輔酶Q10、破壁靈芝孢子粉、螺旋藻、魚油、褪黑素。2021年3月1日,正式實施。
⑤ 進入2021年,市場監管總局又先后發布了這5種非營養素備案的產品劑型及技術要求。
從2017到2021年,我們看到了功能原料進入備案目錄是一個逐步推進的過程,隨著這5種原料的備案成功,也讓我們看到了未來將有更多功能性原料進入保健食品原料目錄的可能。
隨著2021年3月1日相關備案法規的正式實施,再讓我們一起回顧溫習一下有關輔酶Q10等五種保健食品原料目錄備案產品技術要求的關鍵點。
關鍵點1:保健食品原料
根據2020年12月1日發布的輔酶Q10等五種保健食品原料目錄的公告,植提橋將這五種保健食品原料目錄匯總如下表,法規明確規定了這五種原料的用量范圍、適宜人群、注意事項及可以聲稱的健康功效。
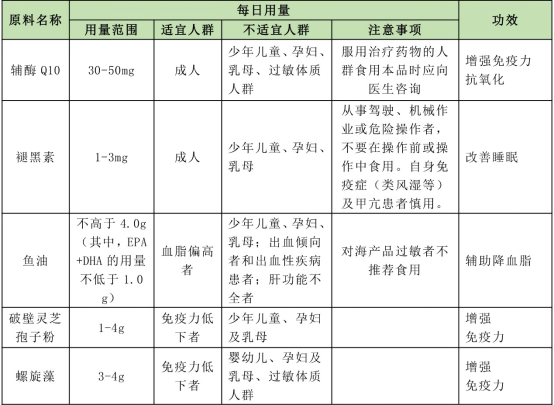
魚油、螺旋藻也是普通食品,但這里法規明確表示了列入保健食品原料目錄的原料及用量和對應的功效只能用于保健食品生產,不能用于其他食品生產。
也就是說保健食品原料目錄中的原料、用量、功效必須是一一對應的關系。
關鍵點2:功能聲稱
輔酶Q10等五種原料在產品備案時,保健功能應當按照原料目錄中對應的保健功能進行標注。其中輔酶Q10包括增強免疫力和抗氧化保健功能,允許備案人選擇其中一種保健功能進行標注,或者同時標注兩個保健功能。如功能聲稱發生調整,本目錄中的保健功能也將相應調整。
關鍵點3:產品劑型
2021年2月20日,市場監管總局發布《保健食品備案產品劑型及技術要求(2021年版)》(2021年6月1日起實施),在原來片劑、硬膠囊、軟膠囊、口服溶液、顆粒劑5種劑型基礎上,新增凝膠糖果、粉劑2種,也就是說今年6月1日起,備案產品劑型正式為7種。
但是輔酶Q10這五種原料的劑型略有差異,必須執行市場總局2021年2月1日發布《輔酶Q10等五種保健食品原料備案產品劑型及技術要求》(2021年6月1日起施行),不能使用的劑型包括凝膠糖果和口服溶液。有關劑型的要求匯總如下:

關鍵點4:可用輔料
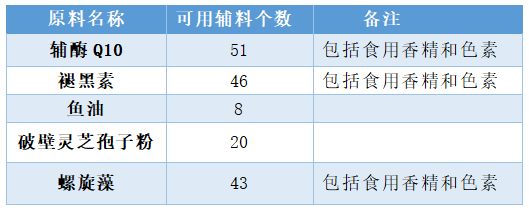
2021年2月20日,市場監管總局發布《保健食品備案可用輔料及其使用規定(2021年版)(2021年6月1日起實施),共涉及197種輔料。輔酶Q10這5種原料的備案產品可用的輔料數量減少很多(詳見下表)。官方解讀指出,如果使用“可用輔料”名單外的輔料,且該輔料在《保健食品備案產品可用輔料及其使用規定(2021年版)》中,申請產品備案時在“其他表明產品安全性和保健功能的材料”中還應提供能支持產品的安全性和功能評價資料、輔料的使用依據、工藝必要性等方面研發資料(包括試驗數據、指標選擇等)以及備案人確保使用該輔料能保證產品安全性的承諾書。
關鍵點5:產品技術要求
五種原料目錄備案產品技術要求中,必須明確原料的來源(包括原料生產企業及原料企業標準等)。各劑型產品技術要求中除應含有符合不同劑型要求的技術指標,微生物指標符合《食品安全國家標準 保健食品》(GB16740)規定外,還應符合各自的特殊要求(詳見下表)。

關鍵點6 :可以備案產品的范圍
輔酶Q10等五種原料進行單方產品的備案僅針對國產保健食品,不包括首次進口的保健食品。
對于已獲得批準證書,再次進口到中國境內的保健食品,不需要進行延續注冊,應在批準證書有效期前申請原注冊人資質確認后,轉為備案管理。對于原料目錄發布前已經受理注冊申請的進口保健食品,使用保健食品原料目錄以內原料的,也作為原注冊人轉為備案管理。